
जल की कठोरता से क्या अभिप्राय है ? जल की कठोरता दूर करने की क्या आवश्यकता है ? जल की कठोरता किस प्रकार दूर की जाती है ?
Contents
जल की कठोरता (Hardness of Water)
जल में कई खनिजों के लवण अर्थात् कैल्सियम, मैग्नीशियम बाइकार्बोनेट, सल्फेट या क्लोराइड, सिलिका, लोहे, जस्ता आदि के लवण विद्यमान होते हैं तो जल को कठोर जल कहा जाता है। इस प्रकार के जल से कपड़ों को धोते समय झाग नहीं बन पाते हैं। इसका कारण होता है कि जल में साबुन को रगड़ने से साबुन् जो स्टेरिएट होता है, कैल्सियम तथा मैग्नीशियम के लवणों से क्रिया कर उसके स्टेरिएट को अवक्षेपित कर देता है। इसके कारण कठोर जल में कपड़े धोने से काफी साबुन का व्यय होता है।
जल की कठोरता के कारण (Causes of Hardness of Water)
कठोर जल के दुष्परिणाम- इसके निम्नांकित दुष्परिणाम हो सकते हैं-
- खाद्य पदार्थों, जैसे—सब्जियाँ पकाते समय कठोर जल का प्रयोग सब्जियों को कठोर बना देता है व रंग भी नष्ट करता है।
- कई लोहे व अन्य विशेष धातु के उपकरण भी खराब कर देता है।
- सर्वप्रथम, कपड़े धोते समय साबुन का अधिक व्यय होता है।
- औद्योगिक प्रयोग में, जैसे-कागज, चमड़ा व कपड़ा उद्योग में विभिन्न स्तर पर कठिनाइयाँ उत्पन्न करता है।
कठोरता के प्रकार (Types of Hardness)
प्राय: जल की कठोरता प्रमुख रूप से दो प्रकार की होती है-
1. अस्थायी कठोरता (Temporary Hardness) – जल में अगर मैग्नीशियम और कैल्सियम के बाइकार्बनिट घुले हों तो यह ‘अस्थायी कठोरता’ कहलाती है। इस कठोरता को उबालकर दूर किया जा सकता है।
2. स्थायी कठोरता (Permanent Hardness) – जल में अगर मैग्नीशियम तथा कैल्सियम क्लोराइड और सल्फेट घुले रहते हैं तो यह ‘स्थायी कठोरता’ कहलाती है। इस कठोरता को साधारण विधियों द्वारा दूर नहीं किया जा सकता है।
कठोरता दूर करने की आवश्यकता
जल की कठोरता को दूर करने के निम्न कारण हैं-
(i) कठोर जल में साबुन से कपड़ा धोने में अधिक साबुन व्यय होता है।
(ii) बॉयलर में कठोर जल उबालने से बर्तन की सतह पर लवणों की एक पर्त जम जाती है, जो ऊष्मा की कुचालक होती है। फलतः जल को गर्म करने में बॉयलर को अधिक ऊष्मा की आवश्यकता होती है।
(iii) बॉयलर में कठोर जल गर्म करने पर उसमें घुलित लवणों की पर्त जल के साथ क्रिया कर अम्ल बनाती है, जो बॉयलर की धातु को विलेय करके बॉयलर में धातु की मोटाई कम करते रहते हैं। मोटाई अधिक कम हो जाने पर बॉयलर के फटने का डर रहता है।
(iv) लवणों के अधिक मात्रा में घुल जाने पर कठोर जल पीने योग्य भी नहीं होता।
जल की कठोरता दूर करना
जल के अन्दर विलेय यौगिकों के आधार पर कठोरता दो प्रकार की होती है
(A) अस्थायी कठोरता- वह कठोरता, जो केवल जल को उबालने से दूर हो जाती है, जल की अस्थायी कठोरता कहलाती है। यह कैल्सियम तथा मैग्नीशियम के बाइकार्बोनेट जल में विलेय होने के कारण होती है।
अस्थायी कठोरता दूर करने के उपाय
(i) जल को उबालकर- अस्थायी कठोर जल को उबालने से उसमें विलेय बाइकार्बोनेट अविलेय कार्बोनेट में बदल जाते हैं, जो बर्तन की पेंदी में बैठ जाते हैं और जल मृदु हो जाता है जिन्हें निथारकर अलग किया जाता है।
Ca (HCO3) 2 →CaCO3 + H2O + CO2
Mg(HCO3) 2→MgCO3 + H2O + CO2
(ii) चूने के द्वारा या क्लार्क विधि – अस्थायी कठोर जल में चूना मिलाने से भी यह कठोरता दूर हो जाती है, क्योंकि चूना बाइकार्बोनेट को कार्बोनेट में परिवर्तित कर देता है।
Ca(OH) 2 + Ca(HCO3) 2 →2CaCO3 + 2H2O
Ca(OH) 2 + Mg (HCO3 ) 2 → MgCO3 + 2H2O + Ca + CO3
(B) स्थायी कठोरता- जल की वह कठोरता जो जल को उबालने से दूर नहीं होती तथा जल में मैग्नीशियम तथा कैल्सियम के क्लोराइड व सल्फेट घुले रहने के कारण होती है, स्थायी कठोरता कहलाती है।
स्थायी कठोरता दूर करने के उपाय
(i) धावन सोडा अथवा सोडियम कार्बनिट द्वारा – धावन सोडा स्थायी कठोर जल में मिलाने से विलेय कैल्सियम तथा मैग्नीशियम के क्लोराइड व सल्फेट अविलेय कार्बोनेट में बदल जाते हैं।
CaSO4 + NaCO3 →CaCO3 + Na2SO4
CaCl2 + Na2CO3→2NaCl + CaCO3
MgSO4 + Na2CO3→ MgCO3 + Na2SO4
MgCl2 + Na2CO3- MgCO3 + 2NaCl
जल में सोडियम लवण विलेय होने पर जल कठोर नहीं होता। इस विधि से जल की अस्थायी कठोरता भी दूर हो जाती है, क्योंकि क्रिया में Ca व Mg के बाइकार्बोनेट, सोडियम बाइकार्बनिट बनाते हैं जिससे जल कठोर नहीं होता।
(ii) आसवन द्वारा – आसवन क्रिया में जल को उबालकर वाष्प में तथा वाष्प को ठण्डा कर जल में परिवर्तित करने पर प्राप्त जल आसुत जल कहलाता है। इस प्रकार प्राप्त जल में कोई लवण विलेय नहीं रहता, कठोर जल क्योंकि विलेय लवण बर्तन में रह जाते हैं। इस विधि से दोनों प्रकार की कठोरता दूर हो जाती है।
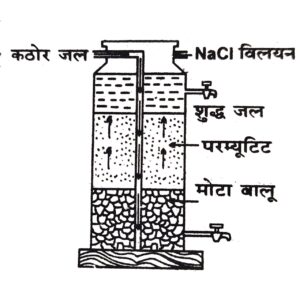
(iii) परम्प्यूटिट विधि – इस विधि में परम्यूटिट (सोडियम जियोलाइट) का प्रयोग करते हैं। इसका सूत्र Na2Al2Si2O8 (सोडियम ऐल्यूमीनियम सिलिकेट) है। सुगमता के लिये Al2Si2O8 (ऐल्यूमीनियम सिलिकेट) के स्थान पर Z लिखा जाता है अत: सूत्र Na2z में प्रदर्शित होता है। जियोलाइट कठोर जल में विलेय यौगिकों से क्रिया कर कैल्सियम तथा मैग्नीशियम के जियोलाइट में परिवर्तित कर देता है तथा सोडियम लवण जल में विलेय होते हैं, जो जल को कठोर नहीं बनाते।
CaSO4 + Na2Z→ CaZ + Na2SO4
MgCb + Na2Z →MgZ + 2NaCl
धीरे-धीरे सम्पूर्ण सोडियम जियोलाइट कैल्सियम जियोलाइट या मैग्नीशियम जियोलाइट में परिवर्तित हो जाता है। इस अवस्था में क्रिया रुक जाती है। इस जियोलाइट में यदि 10% NaCl का विलयन मिला दिया जाये तो फिर से सोडियम जियोलाइट प्राप्त हो जाता है और क्रिया पुनः प्रारम्भ हो जाती है।
MaZ + 2NaCl →MgCl2 + Na2Z
उपरोक्त बर्तन में यह क्रिया विधि चित्र में प्रदर्शित की गई है, इसमें जल बालू की सतह से होकर जियोलाइट के ऊपर जाता है और क्रिया के फलस्वरूप मृदु हो जाता है।
(iv) कालगन विधि- कालगन सोडियम का संकर लवण है। इसका सूत्र Naa[Nai(PO4)6] है। कालगन जल में विलेय लवणों से क्रिया कर जल को मृदु बनाता
2CaSO4 + Na2[ Na4 ( PO4 ) 6 ] →2Na2SO4 + Na2 [Ca2 (PO4)6]
Na2[Ca2(PO4)6] →2Na + +(Ca2 (PO4)6] ‾ ‾
उपरोक्त क्रियानुसार प्राप्त लवण जल में विलेय हो जाता है, किन्तु यह जल को कठोर नहीं बनाते।
(v) आयन विनिमय रेजिन विधि – कुछ समय से जल में सब प्रकार के खनिज लवणों को हटाने के लिये आयन विनिमय रेजिनों का प्रयोग होने लगता है।
एक टंकी को एक रेजिन α ऋणायन से लगभग आधा भरकर उसमें ऊपर से जल को प्रवाहित किया जाता है जो धनायनों का शोषण कर लेता है। इस टंकी से बाहर निकलने वाले जल में कैल्सियम तथा मैग्नीशियम के धनायन नहीं होते अर्थात् वह मृदु होता है। फिर इस मृदु जल को एक दूसरे ऐसे रेजिन β धनायन में भेजते हैं जो ऋणायनों का अवशोषण कर लेता है। इस प्रकार जल में खनिज लवण बिल्कुल नहीं रहते और जल ‘आसुत जल’ जैसा होता है।
IMPORTANT LINK
- नवजात शिशु की क्या विशेषताएँ हैं ?
- बाल-अपराध से आप क्या समझते हो ? इसके कारण एंव प्रकार
- बालक के जीवन में खेलों का क्या महत्त्व है ?
- खेल क्या है ? खेल तथा कार्य में क्या अन्तर है ?
- शिक्षकों का मानसिक स्वास्थ्य | Mental Health of Teachers in Hindi
- मानसिक स्वास्थ्य और शिक्षा का क्या सम्बन्ध है?
- मानसिक स्वास्थ्य का अर्थ एंव लक्षण
- खेलों के कितने प्रकार हैं? वर्णन कीजिए।
- शैशवावस्था तथा बाल्यावस्था में खेल एंव खेल के सिद्धान्त
- रुचियों से क्या अभिप्राय है? रुचियों का विकास किस प्रकार होता है?
- बालक के व्यक्तित्व विकास पर क्या प्रभाव पड़ता है?
- चरित्र निर्माण में शिक्षा का क्या योगदान है ?
- बाल्यावस्था की प्रमुख रुचियाँ | major childhood interests in Hindi
- अध्यापक में असंतोष पैदा करने वाले तत्व कौन-कौन से हैं?
Disclaimer






